검사 의뢰 종류
1)진단면역, 2)임상화학, 3)진단혈액, 4)분자유전, 5)질량분석, 6)전기영동, 7)면역혈청, 8)미생물, 9)병리검사
검사 의뢰지 기입 요령
의뢰항목에 적합한 메디체크랩 프로그램을 사용하여 필요한 내용을 반드시 기록하여 주십시오.
- 검사종목 :전산프로그램에 검사항목 등록
- 진료과 :기관명, 진료과, 담당의사
- 검체정보 :성명, 성별, 나이, 임신정보(여자), 접수번호 등
- 검체 :검체종류, 부위(세포,조직), 채취일 및 시간, 의뢰일 등
검체 채취 방법
- 검체 :각 검체는 메디체크랩의 검사항목에 적합하게 채취하십시오.
- 용기 :용기에 부착되어 있는 라벨에 성명, 연령, 성별, 접수번호를 반드시 기록하십시오.
- 검체수 :동일한 수검자에서 한가지 이상의 검체를 의뢰하는 경우 라벨에 각각 검체명과 검사명을 적어주십시오.
검체 제출과 수송 방법
검체 제출 및 수송과정에 특별한 주의가 필요한 검체(예 : 냉장 운반, 즉시 운반)는 메디체크랩 ‘검사안내 책자’의 검사항목별 지침 내용을 따라주십시오.
검체는 의뢰담당자를 통하여 검체수송업체 담당직원에게 제출하여 주십시오. 제출된 검체는 즉시 수거되어, 익일에 메디체크랩 운송 및 검사가 이루어집니다.
추가검사 요청
추가검사 요청 시 메디체크랩로 연락하여 가능여부를 꼭 확인하여 주시기 바랍니다.
1일 소요되는 검사인 경우, 오후 5시 이전까지 접수된 검사는 익일 정오까지 보고 완료됩니다.
- 스케줄 검사 종목은 검사안내의 검사항목별 검사일 및 소요일에 따라 검사가 이루어집니다.
- 검체가 심하게 오염되거나 변성되었으면 검사를 실시할 수 없습니다. 이 경우는 검체를 재채취하도록 요청합니다.
- 검체량이 부족하면 재검 및 추가 검사가 불가능합니다.
- 응급을 요하는 경우나 기타 문의사항은 메디체크랩로 문의하시기 바랍니다.
검사결과의 보고
검사결과는 메디체크랩 홈페이지에서 실시간 조회 및 출력이 가능합니다.
채혈 지침
채혈 준비
| 채혈 시 필요한 도구 | Tourniquet 사용법 |
|---|---|
|
|
채혈 방법
- 환자 확인
- 공복 여부 확인
- 환자의 팔을 책상 위 (심장위치와 같은)에 올려놓고 천자할 부위 상부에 Tourniquet을 감아주십시오.
- 알코올 솜으로 채혈부위 소독 후 알코올을 말립니다.(알코올이 마르지 않으면 검체 용혈의 원인이 되므로 주의해 주십시오.)
- 주사바늘을 15°각도로 피부에 천자합니다.
- 주사기
- Plunger를 천천히 뒤로 당겨 채혈합니다. 급하게 당기면 용혈을 일으킬 수 있습니다.
- 진공채혈관 정도만큼 충분한 양을 채혈하십시오.
- 진공채혈관
- 받침을 고정시키고 채혈관을 밀어 넣습니다. 채혈이 끝나면 조심스럽게 빼주십시오.
- 연속 채혈 시 Holder로부터 첫 채혈튜브를 제거한 후 두 번째 튜브를 Holder에 밀어 넣으십시오.
- 채혈관이 꽂혀 있는 동안에는 절대로 혈관에서 바늘을 뽑지 않아야 합니다.
- 주사기
- 채혈이 시작되면 Tourniquet을 풀어줍니다.
- 바늘을 제거하고, 채혈부위를 압박해 줍니다.
- 과도한 출혈(5분이상)과 혈청용기의 혈액이 응고되지 않는 경우 의사에게 알려 조치 하여야 합니다.
- 사용된 주사바늘은 반드시 주사바늘 전용 수거통에 버려야합니다.
- 항응고제와 혈액이 잘 섞이도록 바로 Inverting하여 주십시오.
 Mixing 1 time
Mixing 1 time| 튜브명 | 색 | 검사 | Mixing | 첨가제 |
|---|---|---|---|---|
| Sodium Citrate |  |
PT/aPTT, 특수 응고 검사, 응고 인자 | 4회 | 3.2% Sodium Citrate |
| Plain |  |
Blood typing, 약물 | 5회 | Clot activator |
| SST |  |
생화학, 혈청학 | 6회 | Clot activatior & Acrylic gel |
| PST |  |
응급 생화학 | 8회 | Lithium heparin & gel |
| Heparin |  |
혈액 가스 | 8회 | Heparin |
| EDTA |  |
혈액 검사 | 8회 | Spray-dried K2 EDTA |
| Glucose |  |
Glucose 검사 | 8회 | Sodium Flouride & Na2 EDTA |
| NK Vue |  |
NK세포 활성도 검사 | 10회 | NK Cell activator |
| STANDARD ETB-feron |
 |
잠복결핵검사 | 10회 | CFP-10, ESAT-6, TB7.7 |
채혈 순서
- 01

NK Cell activator
(1mL) - 02

S/C
(2.7mL) - 03

Plain
순서상관없음
(6mL) - 04

SST
(5mL) - 05

Heparin
순서상관없음
(10mL) - 06

PST
(4.5mL) - 07

EDTA
(3mL) - 08
CFP-10, ESAT-6,TB7.7
회 →빨 →보
(각 1mL)
분리 및 보관
- 혈액이 진공채혈관(SST)벽면의 도포된 Clot activator에 의해 충분히 응고 될 수 있도록 가볍게 mixing한 후 30분에서 1시간 동안 실온에 세워둡니다.
- 혈청이 분리되기 전인 전혈상태에서 냉장보관(4℃)하게 되면 1시간에 약 0.2mmol/L 정도 혈청 K가 증가하므로 혈청 분리 전까지는 반드시 실온(15-25℃)에 보관하셔야 합니다.
- 응고된 혈액상태에서 2시간이내에 원심분리기를 이용하여 1300-2000RCF(g)에서 10분간 혈청을 분리합니다.
- 원심 분리기가 준비되지 않았을 경우에는 30분에서 1시간 동안 실온에서 응고시킨 후 상단에 분리된 혈청을 신속하게 분리하여 주십시오.
- 분리 후에는 냉장 보관하여 의뢰해 주십시오.
분자유전 검사
- Apo E 검사의 검체는 EDTA tube에 채취된 것을 사용하며, 진공 tube에 혈액 2mL를 채혈한 후 즉시 tube를 아래·위로 8-10회 정도 기울여
EDTA와 혈액이 잘 섞이도록 해야 부분 응고가 방지됩니다. - HPV 관련 검사는 검사항목에 해당되는 전용 용기를 반드시 사용합니다.
- Hepatitis Virus 관련 검사는 항응고제가 없는 SST tube의 사용을 원칙으로 합니다.
- HCV RNA 검사의 경우 RNA가 매우 빨리 분해되므로 혈액을 채취하여 당일 의뢰하여 주십시오.
- RNA Virus를 의뢰한 검체 중 용혈된 검체는 검사결과가 불안정하니 주의하십시오.
- 유전질환이나 기타 신중을 요하는 검사는 반드시 임상소견 및 의뢰목적을 유전자 검사의뢰서에 기록하여 주시고, 유전자 검사동의서와 함께 보내주십시오.
- 검체 보관 및 이송은 냉장 상태로 합니다.
혈액진단 검사
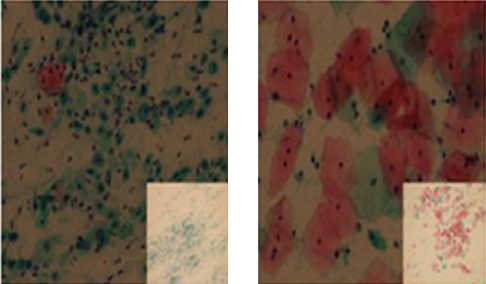
- 채혈 후 3시간 이내에 말초혈액도말 슬라이드를 제작하는 것이 좋습니다.
- 슬라이드 오른쪽 진한 부위에 연필로 수검자 정보(기관명, 수검자명, 성별, 나이 등)를 기재합니다.
- 혈액도말 슬라이드를 충분히 건조하여 슬라이드 케이스에 넣어 CBC 검체와 함께 보내주십시오.
- 깨끗한 유리슬라이드의 오른쪽 끝에서 약 1cm 떨어진 부위에 혈액 한 방울을 떨어뜨립니다.
- 또 다른 슬라이드를 혈액 방울 위에 30-45°로 접촉시킵니다.
- 혈액이 미는 슬라이드 끝을 따라 골고루 퍼지면 곧바로 일정한 속도와 각도로 도말합니다.
- 도말의 길이는 약 3-4cm가 적당하며, 신속히 건조하여야 합니다. (건조가 늦어지면 세포형태의 변형이 초래됩니다.)
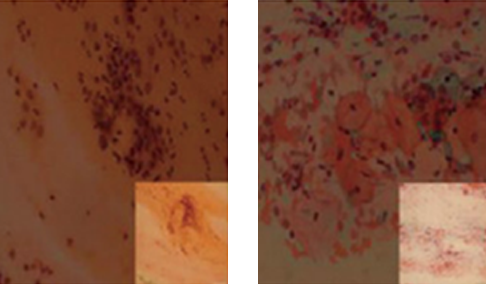
자주 발생하는 부적합한 말초혈액도말 슬라이드
- 혈육안확인
-
슬라이드와 맞닿은 스프레더 슬라이드(spreader slide)의 면이 부서지거나 거칠 경우
-
도말 속도가 불규칙적일 경우
-
스프레더 슬라이드 면에 혈액이 충분히 펴지지 않을 경우
-
슬라이드에 떨어뜨린 혈액의 양이 부족할 경우
-
혈액이 슬라이드의 폭에 맞춰 퍼지지 않은 경우
-
슬라이드가 깨끗하지않거나 기름질 경우 (혈액 내 지질성분이 많을 경우)
-
슬라이드와 스프레더 슬라이드 간의 압력이 일정하지 않을 경우
-
혈액을 떨어뜨린 후 늦게 도말할 경우
-
- 부적합 슬라이드의 혈구 형태
- 건조 지연 또는 슬라이드 표면의 습기에 의한 artifact
- 문제점 : 적혈구 형태 관찰 불가
- 해결방법 : 도말 후 즉시 건조하고 슬라이드 표면이 습기에 노출되지 않도록 합니다.
- 포르말린 가스에 의한 artifact
- 문제점 : Wright 염색 후 슬라이드가 뿌옇고 파랗게 변형됨
- 해결방법 : 슬라이드를 비닐봉지 안에 넣어 노출을 최소화하고 조직검체와 분리하여 보관합니다.
- 건조 지연 또는 슬라이드 표면의 습기에 의한 artifact
잠복결핵 검사
- 채혈 튜브는 2-25℃의 온도에 보관하여 주시고 채혈 전에는 15-25℃에 꺼내어 상온화 시켜 주십시오.
- 채혈 순서를 반드시 지켜주시기 바랍니다.(바뀔 시 오염으로 인한 부정확한 결과를 초래합니다.)
- Nil(Gray) → TB Ag(Red) → Mitogen(Purple) - 채혈양이 부족할 경우 세포량이 확보되지 않아 결과에 변동이 있을 수 있으므로 채혈양을 반드시 준수해 주시 기 바랍니다.
- 최적의 반응을 위해 차가운 상태에서 채혈을 금합니다.
- 채혈 즉시 기포가 생기지 않게 10회 shaking 한 후 15-25℃에 보관하여 주십시오.
- 채혈 후 16시간 안에 incubation 시작하여주십시오.
- incubator에 들어가기 전까지 채혈된 튜브는 반드시 15-25℃로 유지하여 주십시오.
- 배양온도 : 37±1℃ (튜브를 세워서 배양해야 합니다.)
- 배양시간 : 16-24시간
- 배양 후 원심분리를 바로 하지 못할 시 2-25℃에서 최대 1일간 보관 가능합니다.
- 원심 분리한 plasma의 경우 2-8℃에서 7일간 보관 가능합니다.
- 배양하기 전 전혈 검체의 냉장 혹은 냉동 보관을 금합니다.
- 배양 후 15분 동안 RCF 2200~2300g 조건에서 원심분리 하십시오.
NK세포 활성도검사
- 냉장보관한 NK전용튜브는 꺼낸 즉시 사용합니다.
- 채혈튜브의 검은색 선 표시되어있는 곳까지 혈액 1mL를 채혈합니다.
- 여러종류의 튜브를 함께 사용하는 경우, NK전용튜브를 가장 먼저 채혈합니다.
- Syringe로 채혈해서 분주한 경우, 반드시 NK전용튜브 뚜껑을 열고 정량 분주합니다.
- 채혈 후 10회 inverting합니다. (롤러사용을 금합니다.)
- 채혈 후 즉시 배양을 시작하여 주십시오. 채혈 후 30분까지는 활성도가 유지되나, 이후 시간이 경과됨에 따라 수치에 영향을 줄 수 있으며, 최대 1시간 이내에는 배양 시작을 권고합니다.
- 배양온도 : 37±1℃ (튜브를 세워서 배양해야 합니다.)
- 배양시간 : 20-24시간
- 배양이 끝난 후 상층액과 혈구가 혼합되지 않도록 주의하여 상층액을 따서 plain 튜브에 옮깁니다.
- 상층액 plasma는 2-8℃에서 의뢰하여 주십시오.
미생물 검사
장내세균 검사
- 면봉에 이상이 없는지 확인하고 주위에 오염되지 않게 조심해서 꺼내 주십시오.
- 한 손으로 항문 부위를 노출시키고 다른 한 손으로 면봉을 넣어주십시오.
- 약2.5~4cm정도 삽입하고 직장 벽을 향해 돌리면서 천천히 빼주십시오.
- 면봉에 분변이 충분히 묻어 있는지 확인 후 면봉을 수송배지에 넣은 후, 뚜껑이 열리지 않게 잘 닫아주십시오.
- 추가적으로 콜레라검사가 있는 경우 반드시 면봉 2개 모두 채취해 주십시오.
- 검체보관 및 이송은 냉장상태로 해주십시오.
감염관리 배양검사
- 내시경 scope의 Air/water 및 suction cylinder를 멸균증류수를 묻힌 수송배지로 2~3회 swab하여 검체를 수집해 주십시오.
물배양 검사
- 멸균용기(conical tube)에 무균적으로 채취하여 5cc이상 담아 주십시오.
조직 · 세포병리 검사
조직 병리검체 취급방법
- 검체의 고정
- 고정액은 10%중성 포르말린으로 조직의 10-20배 정도의 양을 사용하여 조직이 완전히 담기게 하고, 실온에서 고정합니다.
- 포르말린을 사용하는 목적은 검체 보존성이 뛰어나며, 조직의 자가융해(autolysis)와 건조를 방지하기 위한 것입니다.
- 포르말린 이외의 생리식염수나 알코올 등의 기타용액은 절대 사용해서는 안됩니다.
- 고정액이 없을 경우, 생리식염수에 적신 거즈로 조직을 싸서 냉장 보관합니다. 그리고 최대한 빨리 고정액에 옮겨 담아야 합니다.
- 채취부위가 다른 곳이라면 다른 용기에 담아 고정하십시오.
- 작은 생검 조직은 여과지에 올려 조직의 유무와 조직의 개수를 확인합니다.
- 조직용기는 입구가 넓어야 하고, 고정액이 새지 않도록 밀봉해야 합니다.
- 수검자간의 검체가 바뀌지 않도록 주의합니다.
- 검사의뢰서 작성
- 환자의 이름, 성별, 생년월일, 차트번호, 의뢰기관명을 확인합니다.
- 채취부위, 채취방법, 임상소견을 영문으로 정확히 기록합니다.
예시) Stomach,antrum,biopsy; Erosive lesion,R/O EGC Colon, ascending, snare polypectomy; Polyp, R/O Polypoid carcinoma - GI tract(gastrointestinal tract)인 경우, biopsy, forceps polypectomy에서는 resection margin에 대한 평가가 불가능하므로 병리진단지에 언급하지 않습니다.
- snare polypectomy, endoscopic mucosal resection인 경우 resection margin을 평가하여 병리 진단지에 기록하고 있습니다.
- 기타 시술방법에서는 resection margin의 평가가 필요한 경우 의뢰지에 별도로 표기해 주시기 바랍니다.
- 전염성 질환, 과거병력 및 특이사항을 기록합니다.
- 의뢰서에 육안상 확인된 조직 개수를 기록합니다.
- 응급일 경우 검체용기와 의뢰서에 응급사유와 “응급”이라고 알아보기 쉽게 표기합니다.
세포병리 검사
- 세포검사용 검체
- 검체채취 하루 전에 질 내 치료나 피임약제 등의 사용을 금합니다. 검체 채취 전 외상치료나 biopsy등을 행한 경우 혈액이 슬라이드에 도말되어 판독이 어려워지므로 피합니다.
- 검체는 cytobrush를 사용하여 충분한 양을 채취해야 합니다.
- 검체는 채취한 후 slide에 얇고 균일하게 도말하고, 세포변성을 방지하기 위하여 95% ethylalcohol 또는 cytospray 등 피복 고정체(coating fixation)으로 고정합니다.
- 검체 용기에 검사자의 성명, 번호, 의뢰처 등의 정보를 반드시 기재합니다.
- 검체 채취 후 검체 용기의 마개를 단단히 막아 검체 유실을 방지합니다.
- 일반 자궁질도말검사용 검체
- 일반 자궁질도말검사 고정
- 도말 된 슬라이드는 즉시 95%에틸알코올에 담구어 최소 30분 이상 고정합니다. (메틸알콜 사용금지)
- 충분히 고정된 슬라이드는 완전히 건조시킨 후 수송용 PAP통에 넣습니다.(도말된 슬라이드의 경우 습기와 포르말린 성분에 의해 세포 변성을 일으킬 수 있습니다.)
- 수송용 PAP통 안에 제습제를 넣어 남아 있는 습기를 제거할 것을 권합니다.
- 매일 업무종료 후 사용한 95%에틸알코올은 폐기하고 고정용 용기는 깨끗이 씻어 건조시킵니다.
- 검사시작 전 건조된 고정용 용기에 신선한 95%에틸알코올을 슬라이드가 충분히 잠길 만큼 부어서 사용합니다.
- 검사 중에 95%에틸알코올이 휘발되지 않도록 고정용 용기의 뚜껑을 닫고 사용합니다.
- 수송용 PAP통은 지퍼팩에 넣어 밀봉한 뒤 흔들리지 않도록 행낭에 고정시켜 의뢰합니다.
- 토요근무 및 담당자 변경 시 위의 사항을 반드시 인계하여 주십시오.
- 일반 자궁질도말검사 고정
- 액상세포검사용 검체
- 액상 자궁경부 검사
- 윤활제를 묻히지 않고 자궁경을 사용해 자궁경부의 세포를 솔로 채취합니다.
- 솔을 보존액 용기에 넣어 2-3회 충분히 흔들어 준 후 사용한 솔은 폐기합니다.
- 액상 자궁경부 검사
- 일반 자궁질도말검사 고정
고정양호
고정불량
- 액상검사 검체 처리 방법
- 부인과 검체
- 각 브러쉬로 채취한 검체를 PreservCyt 보존액병에 넣고 바닥면으로 솔이 휘어져 서로 벌어지도록 10회 이상 밀면서 충분히 회전시켜 검체를 모두 씻어낸 후 브러쉬는 버려주십시오.
(단, 삼각 브러쉬의 솔부분을 용기안에 넣지 않습니다.).
- 각 브러쉬로 채취한 검체를 PreservCyt 보존액병에 넣고 바닥면으로 솔이 휘어져 서로 벌어지도록 10회 이상 밀면서 충분히 회전시켜 검체를 모두 씻어낸 후 브러쉬는 버려주십시오.
- 소변(Urine) 및 객담 (Sputum)
- 액상 수송용 용기에 신선한 검체 50ml를 넣습니다.
- 세침흡인물 (FNA)
- 채취한 검체를 액상 수송용 용기에 직접 넣습니다.
Aspriation 후 syringe needle을 분리 한 후 튜브 안에 들어있는 보존액(CytoLyt®solution)을 syringe 안으로 빨아 들인 후 다시 튜브 안으로 넣습니다.
Needle을 syringe에 다시 연결한 후 보존액 용기벽에 밀착하여 부드럽게 검체를 넣습니다. 보존용액을 다시 빨아 들인 후 넣는 과정을 반복 실시합니다.
- 부인과 검체
의료종사자 보호를 위한 주의사항
- 날카로운 물체를 다룰 때에는 다치지 않도록 특히 조심하여야 하며, 폐기 할 때에는 튼튼한 용기에 버려 다른 사람이 감염되지 않게 하여야 합니다.
- 주사바늘을 구부리거나, 꺾거나, 다시 마개를 끼우는 등의 조작을 해서는 안되며, 사용 후에는 반드시 주사 바늘통에 넣어야 합니다.
- 모든 검체는 HIV, B형 또는 C형간염바이러스 등 혈액으로 전파되는 병원체를 갖고 있는 것으로 간주하여 조심성 있게 취급하여야 하며
검체가 외부로 새지 않도록 뚜껑이 꼭 맞는 용기를 사용합니다. - HIV 검사를 의뢰할 때 양성으로 판정되었거나 의심되는 검체는 수거, 접수 시 파손 및 누출되지 않도록 밀봉하여 포장합니다.
| 찔렸을 경우 |
|
| 묻었을 경우 |
|
| 엎질렀을 경우 |
|
| 눈에 들어갔을 경우 |
|
| 상처가있는 경우 |
|